置换反应的原理是单质与化合物反应生成另外的单质和化合物的化学反应。
置换反应是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。它是一种单质与一种化合物作用,生成另一种单质与另一种化合物的反应。
置换反应可表示为A+BC=B+AC 或 AB+C=AC+B,通常认为置换反应都是氧化还原反应,但是一些特殊的反应,例如金属羰(tāng)基化合物间的置换,则不族尘梁是氧化还原反应。
扩展资料:
金属置换的特点:
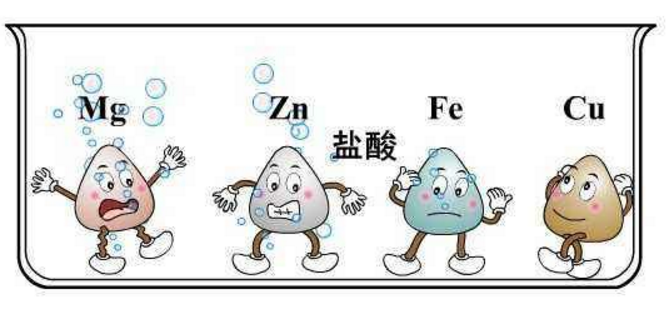
金属活动性顺序简表(K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au)中,10号氢是过渡元素,它前面的通常可以置换出氢(有例外),它后面的则不可以。也就是说,氢前面的可以和酸反应生成氢气,而氢后面的基本不和酸反应,就兄毕算反应也不生成氢气。
钾、钙、钠与水迅速反应,放出氢气,部分金属可能会有爆炸现象;与非氧化性酸反应激烈;由于存在与水的反应,不能置换活动性较弱的金属的离子;对应的金属阳离子基本不具兆运有氧化性。氢氧化物可以电离出氢氧根离子,使溶液呈碱性。
参考资料来源: