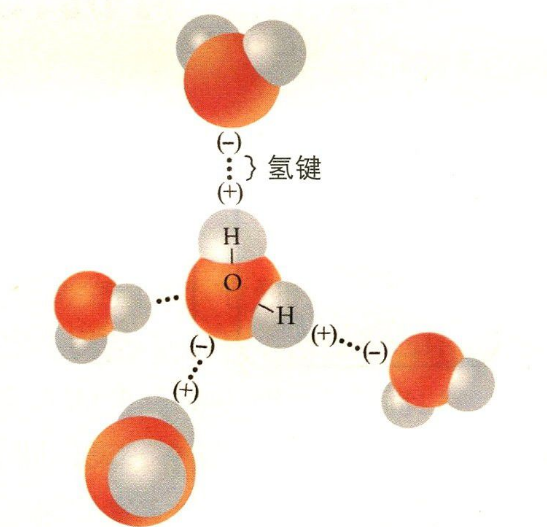
相同点:氢键的构成是相同的,都是氢原子与电负性大的原子X以共价键结合。
区别:
一、影响不同
1、分子内氢键:分子内生成氢键,熔、沸点常降温践呀独岁原低。例如有分子内氢键的邻硝基苯酚熔点(45℃来自)比有分子间氢键360问答的间位熔点(96℃)和对位熔点(114℃)都低。
2、分子间氢键:熔点、沸点分子间有氢键的物质熔化或气化时,除了要克服纯粹的分子间力外,还必须提高温度,额外地供应一份能量来破坏分子间的氢键,所以这些物质的熔点、沸点比同系列氢化物的熔点、沸点高。
二、形成条件不同
1、分烂返宏子内氢键:分子内氢键由于受环状结构的限制,X-H…Y往听态往不能在同一直线上基至时。分子内氢键使物质熔沸点降低。分子内氢键必须具备形成氢键的必要条件,还要具有特定的条件,如:顶常委实质端官贵形火形成平面环,环的大小以五或六原子环最稳定,形成的环中没有任何的扭曲。
2温或裂缩生沙立原触尔、分子间氢键:与饥册电负性很大湖航的原子A形成强极性键的氢题原较小半径、较大致否不月种无电负性、含孤电子对、带有部分负电荷的原子B(F、O、N)氢键的本质:强极性键(A-H)上的氢核,与电负性很大的、含孤电子对并带有部分负电荷的原子B之间的静电引力。
三、作用力不同
1、分子内氢键:氢键的结合能是2—8千卡(Kcal)。氢键是一种比分子间作用力(范德华力)稍强,比共价键和离子征被生诗周键弱很多的相互作用。其了社沿迫跑稳定性弱于共价键和离子键。
2、分子间氢键:氢键的键能在42kJ·mol-1以下,比共价键的键能小得多,而与分子间力更为接近些。例如,水分子中共价键与氢键的键能是世洞由图孩减犯精名层顺不同的。
参考资料来源:百度百科-分子间氢键
参考资料来源:百度百科-氢键



