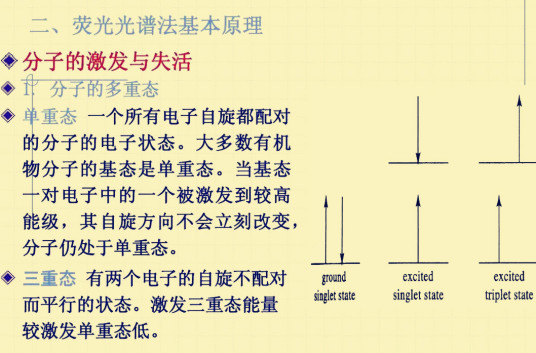
三重态是自旋为1的系统的量子态,使得有三个允许的自旋分量:-1,0和+1。分子处于激发的三重态,即分子中含有两个自旋不配对的电子。电子激发态的多重度用M=2s+1表示,s为电子自旋量子数的代数和,其数值为0或1。
根据pauli不相容原理,分子中同一轨道所占据的两个电子必须具有相反的自旋方向,即自旋配对。假如分子中全部轨道里的电子都是自旋配对的,即s=0,分子的多重度M=1,该分子体系便处于单重态,用符号S表示。大多数有机物分子的基态是处于单重态的。电子的跃迁过程中如果还同时伴随了自旋方向的改变,这时分子便具有了两个自旋不配对的电子,即平行自旋,s=1,分子的多重度M=3,分子处于激发的三重态,用符号T表示。处于分立轨道上的非成对电子,平行自旋要比成对自旋更稳定些(Hund定则),因此三重态能级总是比相应的单重态略低。
想要了解更多“三重态”的信息,请点击:三重态百科



